基因编辑技术已成为现代生命科学领域的革命性突破,其精准性和高效性为医学、农业及工业发展开辟了全新路径。本文将从技术发展、应用现状、挑战及未来趋势等维度展开分析,探讨其在科学实践与社会治理中的多维影响。
一、基因编辑技术的发展历程与核心原理
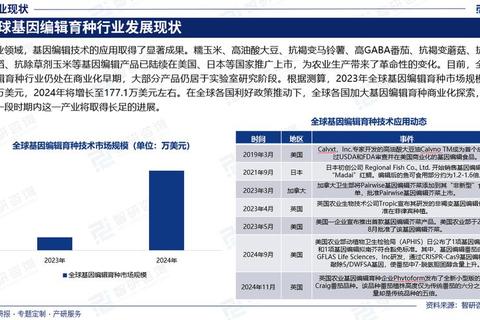
基因编辑技术的演进经历了从“粗放型”到“精准化”的跨越。早期技术如锌指核酸酶(ZFNs)和转录激活样效应子核酸酶(TALENs)虽然实现了靶向基因修饰,但设计复杂、效率低下的缺陷限制了其应用。2012年CRISPR-Cas9系统的发现彻底改变了这一局面。CRISPR技术利用向导RNA(sgRNA)与Cas9蛋白的协同作用,通过切割DNA双链并依赖细胞修复机制实现基因敲除、插入或替换,其操作简便、成本低廉的特点使其迅速成为主流工具。
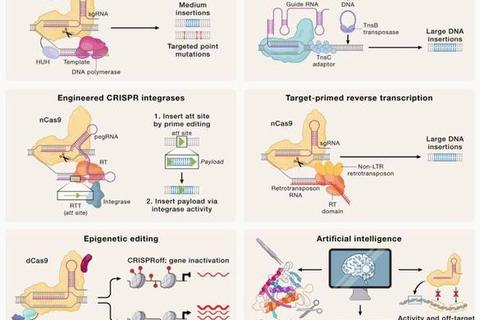
近年来,技术迭代进一步提升了精准度。例如,高保真Cas9变体通过突变优化减少了脱靶效应,而先导编辑(Prime Editing)技术无需依赖双链断裂即可完成单碱基修改,显著降低了染色体异常风险。人工智能的引入推动了新型编辑工具的诞生,如OpenCRISPR-1通过AI设计实现了更高特异性,并开源促进技术普惠。
二、基因编辑技术的应用现状与突破性进展
1. 医学领域的治疗革命
基因编辑在遗传病治疗中展现出巨大潜力。以镰刀型细胞贫血为例,Beam Therapeutics开发的BEAM-101通过体外编辑造血干细胞,模拟胎儿血红蛋白表达,使患者摆脱输血依赖。在体内治疗方面,Verve Therapeutics的VERVE-101利用LNP递送单碱基编辑器,通过一次注射降低LDL胆固醇水平,为心血管疾病提供了治愈可能。CRISPR技术还被用于癌症免疫治疗,如编辑T细胞增强其肿瘤识别能力。
2. 农业与工业的创新实践
在农业领域,基因编辑技术通过改良作物抗逆性提高产量。例如,抗虫玉米和耐旱水稻的培育减少了农药使用与资源消耗。工业上,该技术被用于优化微生物代谢途径,生产生物燃料和可降解材料,推动绿色经济发展。
3. 基础研究的工具革新
基因编辑技术为解析基因功能提供了精准手段。通过构建基因敲除模型,科学家揭示了阿尔茨海默病中tau蛋白异常磷酸化的机制,并发现p53泛素化加速神经元衰老的路径。此类研究为药物靶点开发奠定了基础。
三、技术挑战与争议
1. 科学瓶颈:精准性与安全性
脱靶效应仍是基因编辑的核心风险。研究表明,部分CRISPR操作可能影响多达1500个非目标基因,导致不可预见的生物学后果。递送系统的局限性限制了体内编辑效率,例如病毒载体的免疫原性和脂质纳米颗粒(LNP)的组织靶向性不足。
2. 与社会争议
四、未来趋势与治理建议
1. 技术创新方向
2. 与政策框架
3. 临床应用转化
推动产学研合作,加速疗法落地。例如,简化基因治疗审批流程,设立专项基金支持罕见病研究。需完善长期随访机制,评估编辑效果的持久性与潜在风险。
五、结论
基因编辑技术正站在科学与社会治理的交叉路口。其在疾病治疗、粮食安全等领域的价值毋庸置疑,但技术风险与争议要求我们以审慎态度推进应用。未来,唯有通过技术创新、约束与政策协同,才能实现“编辑生命”与“敬畏生命”的平衡,确保技术真正服务于人类福祉。
参考文献(示例):
1. 基因编辑技术的机制与应用进展(Cell, 2024)
2. 挑战与社会影响分析(基因编辑挑战, 2024)
3. 临床转化案例与趋势(Evaluate Vantage行业报告, 2023)
4. 政策建议与治理框架(周琪院士访谈, 2016)


